《著名化学名著《现代农药化学》》
第五届中华优秀出版物奖评选结果揭晓并颁奖,由南开大学元素有机化学所杨华铮教授等编著,化学工业出版社出版的大型农药专著——《现代农药化学》获得第五届中华优秀出版物(图书)奖。小编在这里整理了《现代农药化学》相关资料,希望能帮助到您。
农药品种及其生产过程和安全使用的“绿色性”要求,已经形成21世纪农药研究的时代特征。新农药的研究已经进入开发超高活性及环境友好产品的“绿色生态化”时代。通过探讨农药与作用靶标间的相互作用来开展新农药创制的“生物合理的”农药分子设计策略正成为新的研究热点和主流,同时对已应用的农药品种生物化学基础的认识也在不断提高,这对于农药进入“绿色生态化”时代具有重要的意义。在这种新形势下,传统的以化学合成为主线介绍农药化学的专业书籍已远不能满足需要,亟需一本从新的角度来介绍农药基本内容的专业图书。
《现代农药化学》首次以农药作用机制为“主线”,系统阐述了农药的发现、发展、结构与活性的关系、优化历程及其化学与生物学之间的相互关系,重点阐述了农药作用机理中靶位的分子生物学基础与作用原理等内容。该书全面地反映了当前国际国内新农药创制及应用的前沿进展,在推动我国农药创制科学技术提升,促进我国创新性的开展绿色、清洁、可持续发展的农药生产工艺升级换代,推动我国安全合理使用农药,尽量避免和延缓抗性和交互抗性的产生,提高现有农药的应用效率等方面发挥了重要的作用。具有首创性、科学易读性、权威性、指导性、启发实用性等特点。
《现代农药化学》先后入选2013年国家科学技术学术著作出版资金资助项目、2013年首都出版发行联盟“三个一百”原创精品图书资助项目。
中华优秀出版物奖前身为国家图书奖,与“五个一工程”奖、中国出版政府奖并列为中国出版界最高级别奖项,设图书奖、音像电子和游戏出版物奖、出版科研论文奖三个子项,旨在表彰和奖励相关领域优秀作品,每两年评选一次,其中图书奖100种。
物质结构与性质知识汇总
原子核外电子排布原理
1.能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域。这种电子云轮廓图称为原子轨道。

【特别提示】
(1)任一能层的能级总是从s能级开始,而且能级数等于该能层序数。
(2)以s、p、d、f……排序的各能级可容纳的最多电子数依次为1、3、5、7……的二倍。(3)构造原理中存在着能级交错现象。由于能级交错,3d轨道的能量比4s轨道的能量高,排电子时先排4s轨道再排3d轨道,而失电子时,却先失4s轨道上的电子。
(4)前四周期的能级排布(1s、2s、2p、3s、3p、4s、3d、4p)。第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
(5)当出现d轨道时,虽然电子按ns,(n-1)d,np顺序填充,但在书写电子排布式时,仍把(n-1)d放在ns前。
(6)在书写简化的电子排布式时,并不是所有的都是[X]+价电子排布式(注:X代表上一周期稀有气体元素符号)。
2.基态原子的核外电子排布
(1)能量最低原理
电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图。
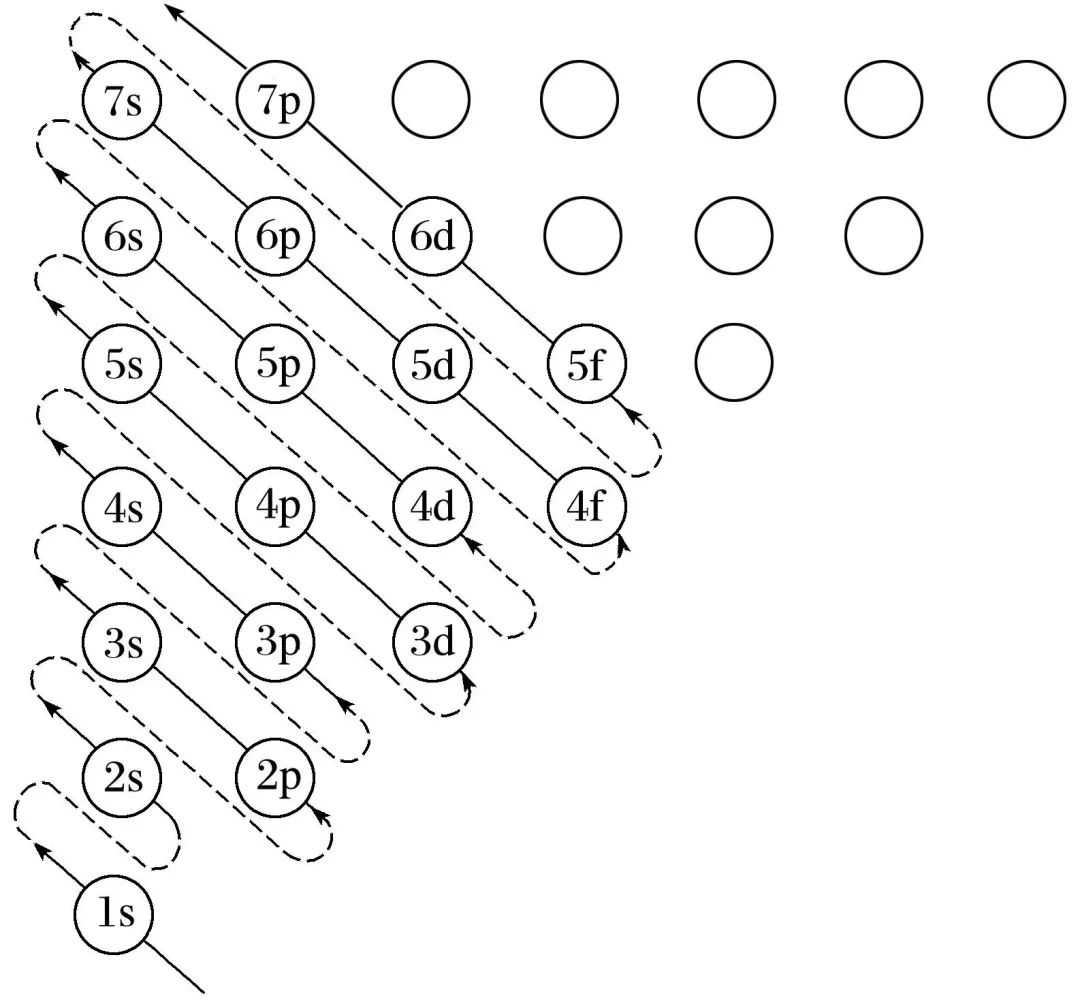
注意:所有电子排布规则都需要满足能量最低原理。
(2)泡利原理
每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
(3)洪特规则
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。
洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低。
3.基态、激发态及光谱示意图
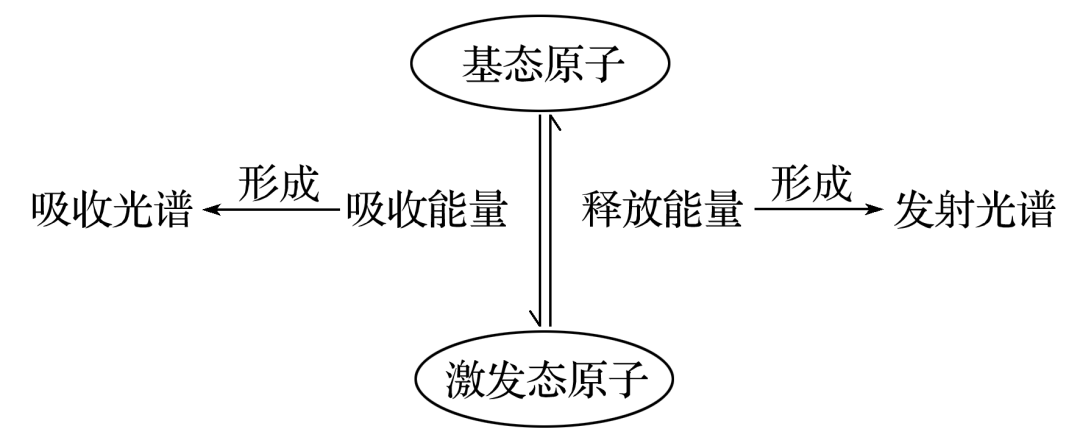
(1)电子的跃迁
①基态→激发态
当基态原子的电子吸收能量后,会从低能级跃迁到较高能级,变成激发态原子。
②激发态→基态
激发态原子的电子从较高能级跃迁到低能级时会释放出能量。
(2)原子光谱
不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的吸收光谱或发射光谱,总称原子光谱。
原子结构与元素性质
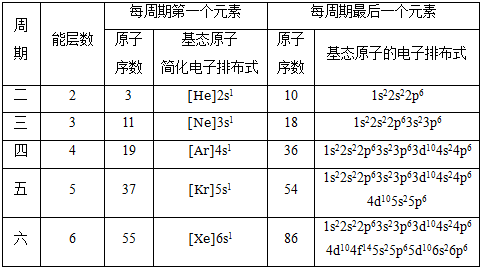
1 . 原子结构与元素周期表
(1)原子结构与元素周期表
(2)每族元素的价层电子排布特点
①主族

②0族:He:1s2;其他ns2np6。
③过渡元素(副族和第Ⅷ族):(n-1)d1~10ns1~2。
(3)元素周期表的分区
①根据核外电子排布
a.分区
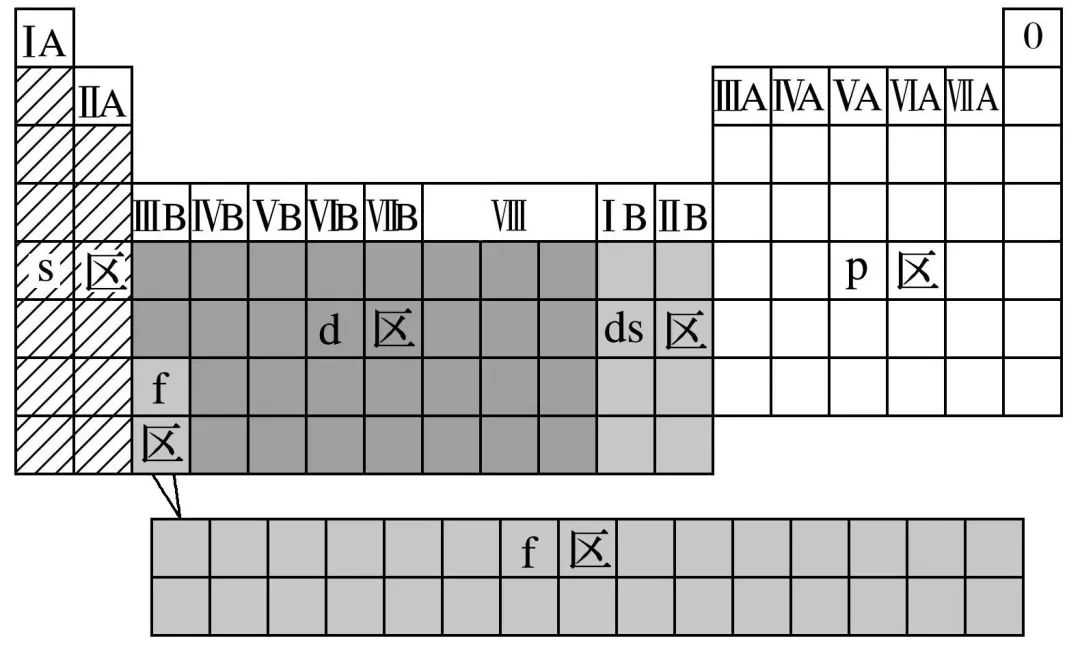
b.各区元素化学性质及原子最外层电子排布特点
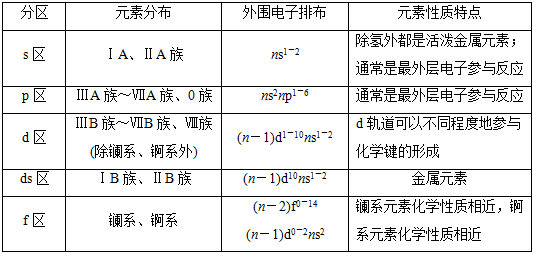
②根据元素金属性与非金属性可将元素周期表分为金属元素区和非金属元素区(如下图),处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属或准金属,但不能叫两性非金属。
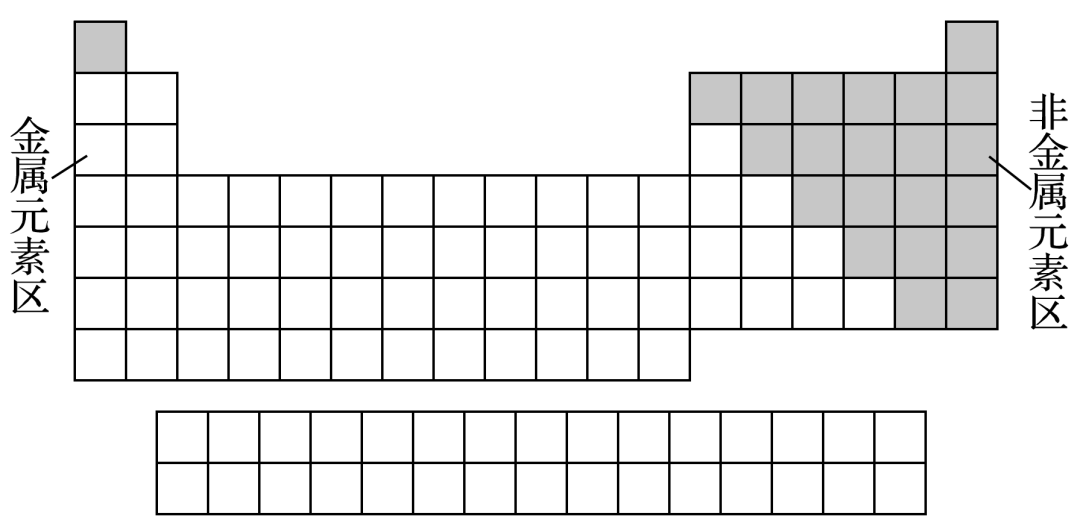
【特别提示】
“外围电子排布”即“价电子层”,对于主族元素,价电子层就是最外电子层,而对于过渡元素原子不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。
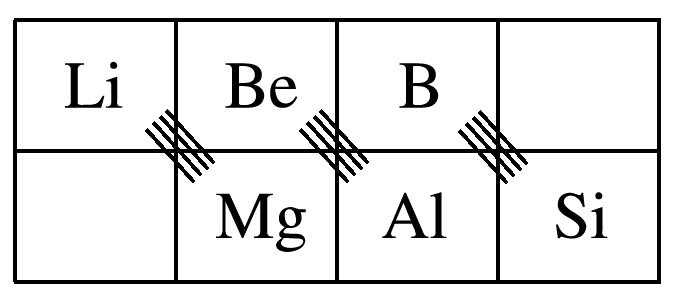
2 . 对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的。
3 . 元素周期律
(1)原子半径
①影响因素
能层数:能层数越多,原子半径越大。
核电荷数:能层数相同,核电荷数越大,原子半径越小。
②变化规律
元素周期表中的同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大。
(2)电离能
①第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号:I1,单位:kJ/mol。
②规律
a.同周期:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。
b.同族元素:从上至下第一电离能逐渐减小。
c.同种原子:逐级电离能越来越大(即I1
(3)电负性
①含义:元素的原子在化合物中吸引键合电子能力的标度。元素的电负性越大,表示其原子在化合物中吸引键合电子的能力越强。
②标准:以最活泼的非金属氟的电负性为4.0作为相对标准,计算得出其他元素的电负性(稀有气体未计)。
③变化规律
金属元素的电负性一般小于1.8,非金属元素的电负性一般大于1.8,而位于非金属三角区边界的“类金属”(如锗、锑等)的电负性则在1.8左右。
在元素周期表中,同周期从左至右,元素的电负性逐渐增大,同主族从上至下,元素的电负性逐渐减小。
4 . 电离能、电负性的应用
(1)电离能的应用
①判断元素金属性的强弱
电离能越小,金属越容易失去电子,金属性越强;反之越弱。
②判断元素的化合价(I1、I2……表示各级电离能)
如果某元素的In+1?In,则该元素的常见化合价为+n。如钠元素I2?I1,所以钠元素的化合价为+1。
③判断核外电子的分层排布情况
多电子原子中,元素的各级电离能逐级增大,有一定的规律性。当电离能的变化出现突变时,电子层数就可能发生变化。
④反映元素原子的核外电子排布特点
同周期元素从左向右,元素的第一电离能并不是逐渐增大的,当元素的核外电子排布是全空、半充满和全充满状态时,第一电离能就会反常的大。
(2)电负性的应用
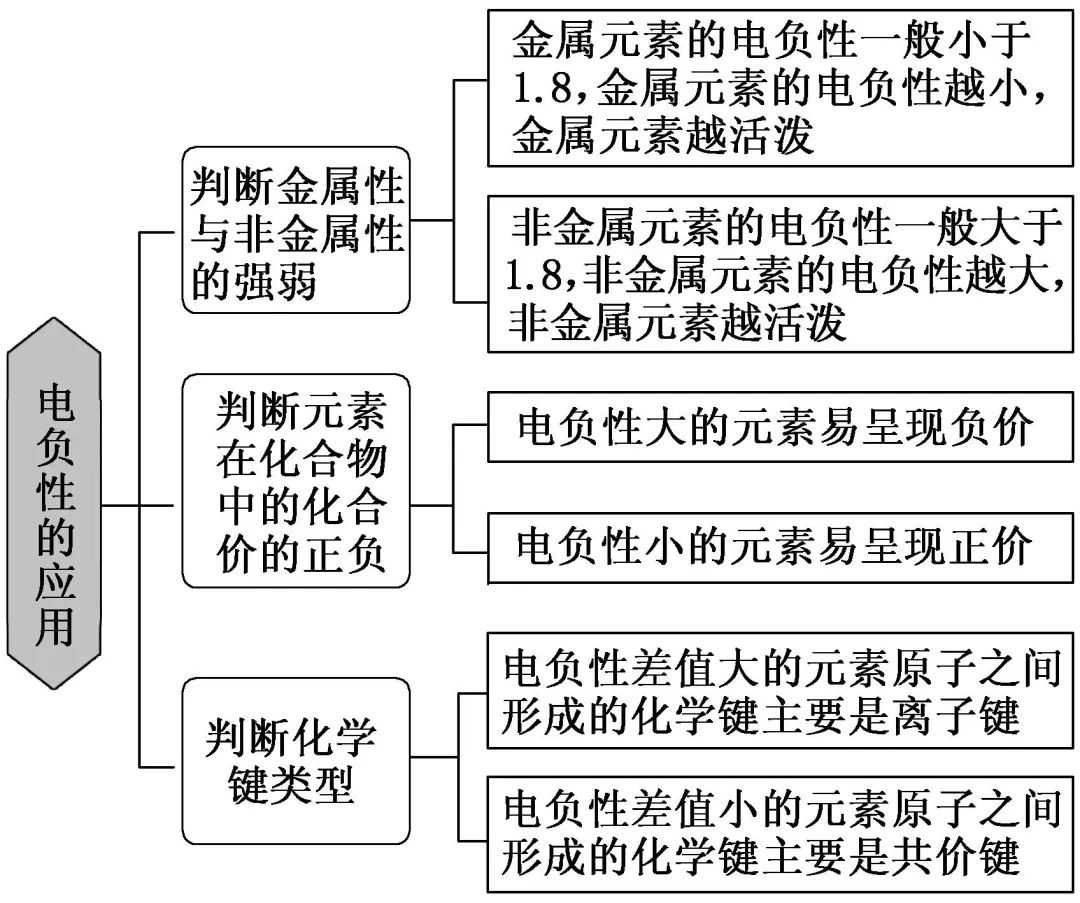
化学名著相关文章:
1.初高中学生必读书目
2.中学生文学名著推荐阅读排行榜
3.初一学生必读书目大全
4.化学家励志故事
5.化学中考备考方案
